Parkinson
en Martina Feichter, medisch redacteur en bioloogdr. med. Fabian Sinowatz is freelancer in de medische redactie van
Meer over de expertsMartina Feichter studeerde biologie met een keuzevak farmacie in Innsbruck en verdiepte zich ook in de wereld van geneeskrachtige planten. Van daaruit was het niet ver meer naar andere medische onderwerpen die haar tot op de dag van vandaag boeien. Ze volgde een opleiding tot journalist aan de Axel Springer Academy in Hamburg en werkt sinds 2007 voor - eerst als redacteur en sinds 2012 als freelance schrijver.
Meer over de experts Alle inhoud van wordt gecontroleerd door medische journalisten.
Bij de ziekte van Parkinson sterven bepaalde zenuwcellen in de hersenen af. Patiënten kunnen alleen langzamer bewegen, de spieren worden stijf. Armen en benen beginnen in rust te trillen. Veel patiënten hebben ook problemen met denken en worden dement. Lees hier: Wat is Parkinson precies? Wie wordt getroffen? Hoe drukt hij zich uit? Welke behandelmogelijkheden zijn er?
ICD-codes voor deze ziekte: ICD-codes zijn internationaal erkende codes voor medische diagnoses. Ze staan bijvoorbeeld in doktersbrieven of op attesten van arbeidsongeschiktheid. G21G22G20
Parkinson: snelle referentie
- Typische symptomen: vertraagde bewegingen, sedentaire levensstijl, spierstijfheid, trillen in rust, onvoldoende stabiliteit van de rechtopstaande houding, starre gezichtsuitdrukkingen
- Oorzaken: Bij de ziekte van Parkinson: Dopamine-producerende cellen in de hersenen sterven af; bij secundaire ziekte van Parkinson: andere ziekten, medicijnen of vergiftiging; bij genetisch bepaald syndroom van Parkinson: genetische veranderingen
- Onderzoeken: lichamelijk en neurologisch onderzoek, L-Dopa-test, computertomografie (CT), kerine-spintomografie (magnetic resonance imaging, MRI)
- Behandeling: medicatie (zoals Levo-Dopa), fysiotherapie, logopedie, ergotherapie, diepe hersenstimulatie (DBS)
Parkinson: symptomen
Stijve spieren, langzame bewegingen en trillende handen zijn typische kenmerken van de ziekte van Parkinson.
Vroege symptomen van Parkinson
Tekenen van progressieve hersenziekte kunnen jaren vóór de belangrijkste symptomen verschijnen. Dergelijke vroege symptomen van Parkinson zijn:
- REM-slaapgedragsstoornis: Normaal gesproken is een persoon "verlamd" in de droomslaap. Bij REM-slaapgedragsstoornis worden enkele van de gedroomde bewegingen uitgevoerd (spreken, lachen, gebaren, enz.). Dit kan gevaarlijk zijn voor de betrokkene en de slapende partner.
- Het reukvermogen is verminderd of faalt volledig (hyposmie/anosmie).
- Pijn in spieren en gewrichten (dysesthesie), vaak in het schouder- en armgebied
- De armen zwaaien minder bij het lopen.
- Opstaan, wassen, aankleden, eten, etc. duren langer dan voorheen.
- constipatie
- Visuele stoornissen (zoals verminderd kleurenzien)
- Het handschrift lijkt krap en wordt kleiner, vooral aan het einde van een regel of pagina.
- depressies
- Vermoeidheid, uitputting
- stijf, onzeker gevoel, beverigheid
- De patiënt trekt zich terug en verwaarloost zijn hobby's.
Veel van deze vroege symptomen van Parkinson zijn erg onspecifiek. Ze kunnen dus ook veel andere oorzaken hebben (zoals hoge leeftijd). Hierdoor worden ze vaak niet herkend als vroege tekenen van Parkinson.
-
Rijden met Parkinson
Drie vragen voor

prof.dr. med. Michael T.Barbe,
Specialist in neurologie -
1
Kun je nog autorijden met Parkinson?
prof.dr. med. Michael T. Barbe
Deze vraag wordt heel vaak gesteld door Parkinsonpatiënten en is helaas niet zo eenvoudig te beantwoorden. In wezen hangt het af van het stadium van de ziekte en de klachten van de patiënt. Als een patiënt na de eerste diagnose nog maar weinig beperkingen heeft en goed is aangepast met medicatie, spreekt niets tegen autorijden. Als er fluctuaties in effect zijn of relevante concentratie- en geheugenstoornissen, raad ik dat in principe af.
-
2
Hoe weet ik of ik nog auto kan rijden?
prof.dr. med. Michael T. Barbe
Interessant genoeg geven de partners van de getroffenen, die zich als passagier niet meer veilig voelen, vaak de eerste aanwijzingen. Ik zou je dan willen adviseren om een rijles te nemen. Je krijgt feedback van de rijinstructeur, die de situatie goed kan inschatten. Natuurlijk kunnen patiënten ook een officiële rijgeschiktheidstest afleggen - als ze niet slagen, moet het rijbewijs worden ingeleverd.
-
3
Kun je als arts mensen verbieden auto te rijden?
prof.dr. med. Michael T. Barbe
Nee, het is meestal niet mogelijk voor patiënten met de ziekte van Parkinson om aan te geven dat ze niet geschikt zijn om te rijden, zoals bij patiënten met epileptische aanvallen. Het is altijd een moeilijke beslissing voor de arts, enerzijds wil je de zelfstandigheid van de patiënt niet inperken, maar anderzijds wil je niemand in het verkeer in gevaar brengen. Ik bespreek dit altijd actief met de patiënten - maar uiteindelijk is het gebaseerd op hun vrijwilligheid.
-
prof.dr. med. Michael T.Barbe,
Specialist in neurologieSenior arts aan de Neurology Clinic and Polyclinic in Keulen, daar hoofd van de werkgroep Bewegingsstoornissen en Deep Brain Stimulation, hoofd van het Parkinson-netwerk in Keulen
REM-slaapgedragsstoornis
Het belangrijkste vroege teken is de REM-slaapgedragsstoornis: iedereen die deze vorm van slaapstoornis vertoont, heeft over het algemeen een verhoogd risico op zogenaamde neurodegeneratieve ziekten. Dit zijn progressieve ziekten die gepaard gaan met het verlies van zenuwcellen. De meeste mensen met een REM-slaapgedragsstoornis ontwikkelen later de ziekte van Parkinson. Anderen ontwikkelen een bepaalde vorm van dementie (Lewy body dementie).
Parkinson: belangrijkste symptomen
Symptomen van de ziekte van Parkinson ontwikkelen zich meestal sluipend. Familieleden en vrienden merken ze vaak eerder op dan de patiënt zelf.
Meestal beginnen de tekenen van Parkinson eenzijdig, d.w.z. aan slechts één kant van het lichaam. Later verspreidden ze zich ook naar de andere kant. Ze worden ook meer en meer uitgesproken naarmate de ziekte vordert.
De typische symptomen van Parkinson zijn:
- Vertraagde bewegingen (bradykinesie) tot een sedentaire levensstijl (hypokinese) of immobiliteit (akinesie)
- stijve spieren (rigor)
- Spiertrillingen in rust (tremor van Parkinson)
- onvoldoende stabiliteit van de rechtopstaande houding (houdingsinstabiliteit)
Vertraagde bewegingen (bradykinesie): Alle lichaamsbewegingen zijn onnatuurlijk langzaam. Dit betekent bijvoorbeeld dat mensen met de ziekte van Parkinson merkbaar langzaam en met kleine stapjes lopen. Na verloop van tijd wordt het lopen geschud en leunen patiënten naar voren. Dit is een van de meest opvallende symptomen. Parkinsonpatiënten kunnen ook langzaam en moeilijk gaan zitten en opstaan. Soms worden de getroffenen plotseling geblokkeerd in hun bewegingen - ze lijken te bevriezen. Artsen noemen dit "bevriezen".
Symptomen van de ziekte van Parkinson hebben ook invloed op gebaren en gezichtsuitdrukkingen: het gezicht lijkt steeds meer op een stijf masker. De getroffenen spreken meestal zacht en eentonig, waardoor ze moeilijker te verstaan zijn. Vaak hebben ze ook problemen met slikken, bijvoorbeeld bij het drinken of eten. Een ander teken van Parkinson is een verminderde fijne motoriek: getroffenen vinden het bijvoorbeeld moeilijk om iets te schrijven, hun jas dicht te knopen of hun tanden te poetsen.
Als de lichaamsbewegingen bijzonder traag zijn of de patiënt gedeeltelijk volledig bewegingsloos is, spreken artsen van akinesie (akinesie).
Stijve spieren (rigor): De ziekte van Parkinson veroorzaakt geen verlamming, maar de spierkracht blijft grotendeels behouden. De spieren zijn echter constant gespannen, zelfs in rust. Het is pijnlijk voor de getroffenen. Vooral het schouder- en nekgebied kan pijnlijk zijn.
Spierstijfheid kan worden aangetoond door het zogenaamde tandwielfenomeen: als de arts de arm van de patiënt probeert te bewegen, wordt dit voorkomen door de stijve spieren. Daarom kan de arm slechts een beetje en schokkerig tegelijk worden bewogen. Het voelt bijna alsof er een tandwiel in het gewricht zit dat alleen beweging toelaat tot de volgende inkeping en dan op zijn plaats klikt. Het versnellingsfenomeen wordt meestal getest in de elleboog of pols. Het is een typisch teken van de ziekte van Parkinson, maar het kan ook bij andere ziekten voorkomen.
Spiertrillingen in rust (rusttremor): Bij de ziekte van Parkinson beginnen armen en benen doorgaans te trillen in rust. Daarom wordt de ziekte ook wel "verlamming" genoemd. De ene kant van het lichaam is meestal meer aangetast dan de andere. Bovendien trilt de arm meestal meer dan het been.
De tremor van Parkinson treedt meestal op in rust. Hiermee kunt u de ziekte van Parkinson onderscheiden van andere ziekten met tremoren (tremor). Als de hand bijvoorbeeld in rust niet trilt, maar zodra je een bepaalde beweging wilt maken, spreken artsen van een zogenaamde intentietremor. De oorzaak is schade of stoornis in het cerebellum.
Trouwens: de meeste mensen die beven hebben geen Parkinson of een andere herkenbare neurologische aandoening. De oorzaak van deze "essentiële tremor" is onbekend.
Onvoldoende stabiliteit van de rechtopstaande houding: Onbewust corrigeert ieder mens zijn/haar houding op elk moment bij het lopen en staan. Het geheel wordt aangestuurd door zogenaamde instel- en houdreflexen. Reflexen zijn automatische bewegingen die worden veroorzaakt door bepaalde prikkels. Dit zijn onbewuste, onwillekeurige bewegingen of spierspanning. De houd- en aanpassingsreflexen van mensen zijn verantwoordelijk voor het feit dat men het lichaam automatisch in evenwicht kan houden, zelfs wanneer men beweegt en dat men niet valt.
Bij de ziekte van Parkinson zijn de instellings- en houdreflexen typisch verstoord. Lijders hebben daardoor moeite om zich stabiel overeind te houden. Dit wordt houdingsinstabiliteit genoemd. Het is de reden waarom Parkinsonpatiënten plotselinge, onvoorziene bewegingen niet meer gemakkelijk kunnen "absorberen" bij bijvoorbeeld struikelen of een plotselinge windvlaag. Daarom zijn ze onveilig tijdens het lopen en vallen ze gemakkelijk.
Zichtbare symptomen bij Parkinson
Parkinson: begeleidende symptomen
De belangrijkste symptomen van Parkinson gaan soms gepaard met andere symptomen:
Parkinsonpatiënten hebben meer kans op een depressie dan gezonde mensen en mensen met andere chronische ziekten. Soms ontwikkelt depressie zich pas als u de ziekte van Parkinson heeft. Bij andere patiënten gaat het vooraf aan de motorische symptomen (langzame beweging, enz.).
Bovendien kan Parkinson de intellectuele prestaties verminderen en dementie ontwikkelen (zie hieronder).De getroffenen hebben steeds meer moeite met denken. Men mag echter niet vergeten dat de meeste gezonde mensen op oudere leeftijd langzamer denken en dingen moeilijker te onthouden vinden. Het hoeft dus geen teken van Parkinson te zijn.
Bij veel Parkinsonpatiënten produceert de huid van het gezicht overmatig talg. Hierdoor ziet het er vettig en glanzend uit. Artsen spreken van het zogenaamde "zalfgezicht": het gezicht van de patiënt ziet eruit alsof de getroffen persoon een dikke laag zalf of gezichtscrème heeft aangebracht.
Mogelijke symptomen van Parkinson zijn ook blaasaandoeningen: veel patiënten kunnen hun blaas niet meer goed onder controle houden. Het kan voorkomen dat de urine onwillekeurig wordt afgevoerd (incontinentie) en dat patiënten zich 's nachts nat maken (enuresis). Maar het tegenovergestelde is ook mogelijk: sommige patiënten hebben problemen met plassen (urineretentie).
Bij de ziekte van Parkinson is de darm vaak traag, waardoor constipatie ontstaat. Dergelijke constipatie kan ook verschijnen als een vroeg teken van de ziekte van Parkinson.
Mannen hebben soms problemen met potentie (erectiestoornissen). Deze impotentie kan zowel het gevolg zijn van de ziekte zelf als van de Parkinson-medicatie.
Alle genoemde begeleidende symptomen kunnen ook worden veroorzaakt door andere ziekten, niet alleen door Parkinson.
Parkinson dementie
Parkinsonpatiënten zijn vatbaarder voor dementie dan de algemene bevolking: ongeveer een derde van de patiënten ontwikkelt ook dementie in de loop van de ziekte. Volgens sommige onderzoeken is het risico op dementie bij Parkinson zelfs nog hoger (tot 80 procent).
De symptomen van Parkinson-dementie zijn voornamelijk verminderde alertheid en vertraagd denken. Dit is een belangrijk verschil met de ziekte van Alzheimer - de meest voorkomende vorm van dementie. Alzheimerpatiënten hebben vooral last van geheugenstoornissen. Bij Parkinson-dementie treden deze echter pas op in latere stadia van de ziekte.
Meer hierover leest u in het artikel Dementie bij Parkinson.
Parkinson: oorzaken
Artsen noemen de ziekte van Parkinson ook primair of idiopathisch Parkinson-syndroom (IPS). "Idiopathisch" betekent dat er geen tastbare oorzaak voor de ziekte kan worden gevonden. Deze "echte" ziekte van Parkinson maakt ongeveer 75 procent uit van alle Parkinson-syndromen. Hij staat centraal in deze tekst. Er moet onderscheid worden gemaakt tussen de zeldzame genetische vormen van Parkinson, het "secundaire Parkinson-syndroom" en het "atypische Parkinson-syndroom". Hieronder worden ze kort beschreven.
Idiopathische Parkinson: Dopamine-deficiëntie
De ziekte van Parkinson begint in een bepaald deel van de hersenen, de zogenaamde "zwarte substantie" (substantia nigra) in de middenhersenen. Dit deel van de hersenen bevat veel ijzer en het pigment melanine. Beide geven de "substantia nigra" een opvallend donkere kleur (vergeleken met het anders lichte hersenweefsel).
De "substantia nigra" bevat speciale zenuwcellen die de neurotransmitter dopamine produceren. Dopamine is erg belangrijk bij het beheersen van beweging. Bij de idiopathische ziekte van Parkinson sterven steeds meer dopamine-producerende zenuwcellen af. Je weet niet waarom.
Als gevolg van deze voortschrijdende celdood blijft het dopaminegehalte in de hersenen dalen - er ontstaat een dopaminetekort. Het lichaam kan dit lange tijd compenseren: pas als ongeveer 60 procent van de dopamine-producerende zenuwcellen is afgestorven, wordt het dopaminetekort merkbaar: de patiënt beweegt steeds langzamer (bradykinesie) of beweegt soms helemaal niet meer ( akinesie).
Dopaminetekort op zich is echter niet de enige oorzaak van Parkinson: het verstoort ook het delicate evenwicht van neurotransmitters: omdat er steeds minder dopamine is, neemt de hoeveelheid van bijvoorbeeld de boodschapperstof acetylcholine relatief toe. Experts suggereren dat dit de reden is voor de tremoren (tremor) en spierstijfheid (rigiditeit) bij de ziekte van Parkinson.
Dat gebeurt met Parkinson
De onbalans van neurotransmitters bij Parkinson kan ook de oorzaak zijn van het feit dat veel patiënten extra depressief worden. Omdat we weten dat de balans van neurotransmitters over het algemeen verstoord is bij depressie. Het verband tussen de ziekte van Parkinson en depressie is nog niet definitief opgehelderd.
De oorzaken van Parkinson: veel gissingen, weinig bewijs
Het is nog steeds onduidelijk waarom zenuwcellen in de "substantia nigra" afsterven bij de ziekte van Parkinson. Onderzoek suggereert dat verschillende factoren een rol spelen bij de ontwikkeling van de ziekte van Parkinson.
Zo hebben wetenschappers ontdekt dat de zenuwcellen bij Parkinsonpatiënten schadelijke stoffen niet goed kunnen verwijderen. Celbeschadigende stoffen zijn bijvoorbeeld de zogenaamde "vrije radicalen". Dit zijn agressieve zuurstofverbindingen die tijdens verschillende stofwisselingsprocessen in de cel ontstaan.
De zenuwcellen bij parkinsonpatiënten zijn mogelijk niet in staat deze gevaarlijke stoffen af te breken voordat ze schade kunnen veroorzaken. Of het vermogen van de cellen om te ontgiften is normaal, maar bij de ziekte van Parkinson wordt een buitensporig aantal "vrije radicalen" geproduceerd. In beide gevallen kunnen de celbeschadigende stoffen zich ophopen in de zenuwcellen en deze doen afsterven.
Er zijn ook andere mogelijke oorzaken van Parkinson die momenteel worden besproken en onderzocht.
Genetische vormen van Parkinson
Wanneer een familielid de ziekte van Parkinson heeft, brengt dit veel familieleden van streek. Je vraagt je af of Parkinson erfelijk is. In de overgrote meerderheid van de gevallen is Parkinson echter de hierboven beschreven idiopathische Parkinson. Overerving is geen probleem met deze sporadische vorm van ziekte, denken experts.
De situatie is anders bij de zogenaamde monogenetische vormen van Parkinson: ze worden allemaal veroorzaakt door een verandering (mutatie) in een bepaald gen. Deze genmutaties kunnen worden doorgegeven aan het nageslacht. Monogene vormen van Parkinson zijn dus erfelijk. Ze worden vaak het familiale Parkinson-syndroom genoemd. Gelukkig zijn ze zeldzaam.
Secundair syndroom van Parkinson
In tegenstelling tot idiopathische Parkinson heeft symptomatisch (of secundair) Parkinson-syndroom duidelijk aanwijsbare oorzaken. Waaronder:
- Geneesmiddelen: remmers van dopamine (dopamine-antagonisten) zoals neuroleptica (voor de behandeling van psychosen) of metoclopramide (voor misselijkheid en braken), lithium (voor depressie), valproïnezuur (voor aanvallen), calciumantagonisten (voor hoge bloeddruk)
- andere ziekten zoals hersentumoren, ontsteking van de hersenen (bijvoorbeeld als gevolg van aids), traag werkende bijschildklieren (hypoparathyreoïdie) of de ziekte van Wilson (koperstapelingsziekte)
- Vergiftiging, bijvoorbeeld met mangaan of koolmonoxide
- Verwondingen aan de hersenen
Atypisch syndroom van Parkinson
Het atypische syndroom van Parkinson ontstaat in de context van verschillende neurodegeneratieve ziekten. Dit zijn ziekten waarbij zenuwcellen in de hersenen geleidelijk afsterven. In tegenstelling tot het idiopathische syndroom van Parkinson treft deze celdood niet alleen de "substantia nigra", maar ook andere hersengebieden. Daarom zijn er bij het atypische Parkinson-syndroom naast Parkinson-achtige symptomen ook andere symptomen.
Neurodegeneratieve ziekten die het atypische syndroom van Parkinson kunnen veroorzaken, zijn bijvoorbeeld:
- Lewy body dementie
- Meervoudige systeematrofie (MSA)
- Progressieve supranucleaire verlamming (PSP)
- Corticobasale degeneratie
Dergelijke ziekten hebben een aanzienlijk slechtere prognose dan het "echte" (idiopathische) Parkinson-syndroom.
Trouwens: het medicijn "L-Dopa", dat heel goed werkt bij idiopathische Parkinson, helpt niet of nauwelijks bij atypische Parkinson.
Parkinson: behandeling
De therapie van Parkinson wordt voor elke patiënt individueel afgestemd. Omdat de symptomen van de ziekte van persoon tot persoon kunnen verschillen en met verschillende snelheden kunnen vorderen.
De meeste Parkinson wordt met medicijnen behandeld, hoewel milde symptomen soms in eerste instantie geen behandeling vereisen. Welke actieve ingrediënten worden gebruikt, hangt vooral af van de leeftijd van de patiënt. Soms kan neurochirurgische interventie ook nuttig zijn - de zogenaamde diepe hersenstimulatie (DBS).
Naast medicatie en zo nodig operatieve maatregelen kan de individuele behandeling van Parkinson ook andere componenten bevatten. Denk hierbij aan fysiotherapie, logopedie en ergotherapie. In ieder geval is het zinvol om u in een speciale Parkinsonkliniek te laten behandelen.
Parkinson-therapie: medicatie
Er zijn verschillende medicijnen beschikbaar voor de behandeling van Parkinson. Ze helpen tegen kwalen zoals trage bewegingen, stramme spieren en tremoren. Ze kunnen echter niet voorkomen dat de zenuwcellen afsterven en dus voorkomen dat de ziekte zich ontwikkelt.
De typische symptomen van Parkinson worden veroorzaakt door een tekort aan dopamine in de hersenen. Ze kunnen worden verlicht door ofwel de boodschapperstof als medicijn toe te voegen (bijvoorbeeld in de vorm van L-Dopa) of door de afbraak van de bestaande dopamine te voorkomen (MAO-B-remmers, COMT-remmers). Beide mechanismen compenseren het dopaminetekort. Je elimineert daarmee grotendeels de typische Parkinson-symptomen.
L-dopa (levodopa)
Het heeft geen zin om de ontbrekende dopamine direct als injectie of tablet aan Parkinsonpatiënten toe te dienen: de boodschapperstof wordt inderdaad via de bloedbaan naar de hersenen getransporteerd. Het kan echter de beschermende bloed-hersenbarrière niet passeren, d.w.z. het kan niet rechtstreeks in het zenuwweefsel komen. De voorloper van dopamine kan dit: Deze L-dopa (levodopa) is daarom geschikt voor de behandeling van de ziekte van Parkinson. Eenmaal in de hersenen wordt het omgezet in dopamine door het enzym dopa decarboxylase. Dit kan dan zijn effect in de hersenen ontwikkelen en de symptomen van Parkinson verlichten, zoals spierstijfheid (stijfheid).
L-Dopa is zeer effectief en heeft weinig bijwerkingen. Het wordt meestal ingenomen in de vorm van tabletten, capsules of druppels. Artsen schrijven het voornamelijk voor aan patiënten ouder dan 70 jaar. Bij jongere patiënten wordt levodopa echter slechts zeer voorzichtig gebruikt. De reden is dat behandeling met L-Dopa na enkele jaren bewegingsstoornissen (dyskinesie) en effectschommelingen (fluctuaties in effect) kan veroorzaken (zie bijwerkingen).
L-Dopa wordt altijd gecombineerd met een andere werkzame stof, een zogenaamde dopa-decarboxylaseremmer (zoals benserazide of carbidopa). Dit voorkomt dat L-dopa in het bloed wordt omgezet in dopamine, dus voordat het de hersenen heeft bereikt. De dopa-decarboxylaseremmer kan zelfs de bloed-hersenbarrière niet passeren. In de hersenen kan L-Dopa dus probleemloos worden omgezet in dopamine.
Elke Parkinsonpatiënt reageert anders op levodopa. Daarom wordt de dosering individueel bepaald: de therapie wordt gestart met een lage dosis en vervolgens geleidelijk verhoogd totdat het gewenste effect optreedt.
Gewoonlijk moet L-Dopa meerdere keren per dag worden ingenomen. Dit moet, indien mogelijk, altijd tegelijkertijd zijn. Op deze manier kan een fluctuerend effect worden voorkomen.
Het is ook belangrijk dat L-Dopa minstens een uur voor of na een eiwitrijke maaltijd wordt ingenomen. Eiwitrijke voedingsmiddelen interfereren met de opname van het actieve ingrediënt in het bloed.
Bijwerkingen: De behandeling van Parkinson met L-Dopa wordt over het algemeen zeer goed verdragen, vooral bij lage doses. Misselijkheid kan echter vooral aan het begin van de therapie optreden. Dit kan echter goed worden verlicht met de werkzame stof domperidon. Andere medicijnen tegen misselijkheid, zoals metoclopramide, mogen echter niet worden gebruikt: ze passeren ook de bloed-hersenbarrière en kunnen de effecten van levodopa neutraliseren.
Andere mogelijke bijwerkingen van levodopa zijn slechte eetlust, duizeligheid, verhoogde drive en depressie. Vooral ouderen ervaren soms hallucinaties, verwardheid en obsessief-compulsief gedrag bij behandeling met L-dopa. Dat laatste uit zich bijvoorbeeld als gok- of winkelverslaving, als een constante drang tot eten of seks, of als dwangmatig ordenen van voorwerpen.
Bewegingsstoornissen (dyskinesie) zijn ook mogelijke bijwerkingen van levodopa: de getroffen patiënten trekken onwillekeurig samen of maken schokkerige bewegingen die ze niet kunnen voorkomen. Hoe langer iemand met levodopa wordt behandeld, hoe frequenter en ernstiger dergelijke bewegingsstoornissen worden.
Langdurige behandeling met levodopa kan er ook voor zorgen dat het effect van het geneesmiddel fluctueert (effectfluctuaties): soms kunnen de parkinsonpatiënten helemaal niet meer bewegen ("OFF-fase"), dan weer volkomen normaal ("ON-phase" ).
In dergelijke gevallen kan het helpen om het doseringsschema van L-dopa te veranderen. Of de patiënt kan overstappen op een vertraagd L-Dopa-preparaat: De vertraagde tabletten geven de werkzame stof langzamer en over een langere periode af dan "normale" (niet-vertraagde) L-Dopa-preparaten. De behandeling werkt dan meestal weer gelijkmatiger.
Bij schommelingen in de effecten van L-Dopa (AAN-UIT-fasen) en/of bewegingsstoornissen kan de arts de patiënt ook een draagbare medicijnpomp geven: deze leidt de levodopa automatisch via een dunne sonde rechtstreeks in de twaalfvingerige darm, waar het in het bloed wordt opgenomen (duodenale sonde). Het actieve ingrediënt wordt daarom continu aan de patiënt toegediend. Op deze manier kunnen zeer gelijkmatige actieve niveaus in het bloed worden bereikt. Dit verkleint de kans op fluctuaties in effectiviteit en bewegingsstoornissen. Een duodenumsonde brengt echter ook risico's met zich mee, bijvoorbeeld voor peritonitis. Daarom wordt het alleen in geselecteerde gevallen en door ervaren artsen gebruikt.
Een alternatief voor pomptherapie is "diepe hersenstimulatie" (zie hieronder).
Dopamine-agonisten
Bij patiënten jonger dan 70 jaar wordt de behandeling van Parkinson meestal gestart met zogenaamde dopamine-agonisten. Pas later vindt de overstap naar het effectievere L-Dopa plaats. Dit vertraagt het ontstaan van bewegingsstoornissen zoals die veroorzaakt worden door langdurig gebruik van levodopa.
Dopamine-agonisten lijken chemisch op de boodschapperstof dopamine. Ze passeren gemakkelijk de bloed-hersenbarrière en leggen aan op dezelfde bindingsplaatsen (receptoren) van de zenuwcellen als dopamine. Daarom hebben ze ook een soortgelijk effect.
De meeste dopamine-agonisten die bij de behandeling van Parkinson worden gebruikt, worden oraal ingenomen (zoals tabletten). Dit geldt bijvoorbeeld voor pramipexol, piribedil en ropinirol. Andere vertegenwoordigers worden toegediend als een pleister met een actief ingrediënt (rotigotine) of als een injectiespuit of infusie (apomorfine).
Bijwerkingen: Dopamine-agonisten worden minder goed verdragen dan levodopa. Ze veroorzaken bijvoorbeeld waterretentie in het weefsel (oedeem), constipatie, slaperigheid, duizeligheid en misselijkheid. Net als L-dopa kunnen dopamine-agonisten hallucinaties, verwardheid en dwangmatig gedrag veroorzaken, vooral bij ouderen.
Bij langdurig gebruik kunnen dopamine-agonisten ook fluctuaties in effect veroorzaken (fluctuaties met AAN-UIT-fasen). Maar dat gebeurt veel minder vaak dan bij levodopa. Het fluctuerende effect kan worden gecompenseerd door de dosering van de dopamine-agonisten aan te passen of door de patiënt over te schakelen van de tabletten naar een pleister met werkzame stof (met rotigotine).
Bij schommelingen in effect is er nog een mogelijkheid: Naast de tabletten krijgt de patiënt injecties met apomorfine in het onderhuidse vetweefsel (subcutaan). Apomorfine kan de symptomen van Parkinson, die ondanks het innemen van tabletten hinderlijk blijven, snel verlichten. Mogelijke bijwerkingen zijn misselijkheid, braken, toegenomen of nieuw optredende bewegingsstoornissen (dyskinesie), duizeligheid, hallucinaties etc.
Als al deze pogingen de schommelingen in het effect niet kunnen compenseren, kan de patiënt een draagbare medicijnpomp (apomorfinepomp) krijgen. Het geeft het actieve ingrediënt continu (meestal meer dan 12 tot 18 uur) af in het onderhuidse vetweefsel op de buik of dij via een dunne buis en een fijne naald.
Tot nu toe is er nog steeds een gebrek aan uitgebreide studies over deze apomorfinepomptherapie. Studies tonen aan dat het de dagelijkse UIT-fasen (waarin de patiënt zich nauwelijks kan bewegen) aanzienlijk kan verkorten. Bewegingsstoornissen (dyskinesie) kunnen ook afnemen met de apomorfinepomp.
Mogelijke bijwerkingen zijn vooral huidreacties op de plaats van het inbrengen van de naald, waarvan sommige ernstig kunnen zijn (pijnlijke roodheid, peulvorming, weefselsterfte = necrose, enz.). Sommige patiënten klagen ook over misselijkheid, braken, problemen met de bloedsomloop en hallucinaties.
MAO-B-remmers
MAO-B-remmers (zoals selegiline) blokkeren het enzym monoamineoxidase-B (MAO-B), dat normaal gesproken dopamine afbreekt. Op deze manier kan het dopaminegehalte in de hersenen van Parkinsonpatiënten worden verhoogd.
MAO-B-remmers zijn minder effectief dan levodopa of dopamine-agonisten. Als enige behandeling van Parkinson zijn ze daarom alleen geschikt voor milde symptomen (meestal in de vroege stadia van de ziekte). Ze kunnen echter worden gecombineerd met andere Parkinson-medicatie (zoals L-Dopa).
Bijwerkingen: MAO-remmers worden als goed verdragen beschouwd.Ze hebben slechts milde en omkeerbare bijwerkingen. Deze omvatten slaapstoornissen, omdat de medicijnen de drive vergroten. Daarom moet men eerder op de dag MAO-B-remmers innemen. Dan wordt de slaap 's avonds niet gestoord.
COMT-remmers
COMT-remmers (zoals entacapon) worden samen met L-dopa voorgeschreven. Ze blokkeren ook een enzym dat dopamine afbreekt (het zogenaamde catechol-O-methyltransferase = COMT). Op deze manier verlengen COMT-remmers de effecten van dopamine.
De actieve ingrediënten worden voornamelijk voorgeschreven om fluctuaties in de effecten van levodopa-therapie te verminderen. Het zijn dus medicijnen voor gevorderde stadia van Parkinson.
Bijwerkingen: COMT-remmers worden doorgaans goed verdragen. Mogelijke bijwerkingen zijn diarree, misselijkheid en braken.
Anticholinergica
De zogenaamde anticholinergica waren de eerste medicijnen die werden gebruikt voor de behandeling van Parkinson. Ze worden tegenwoordig niet zo vaak voorgeschreven.
Door het dopaminetekort bij de ziekte van Parkinson zijn andere neurotransmitters - relatief gezien - in overmaat aanwezig. Dit geldt bijvoorbeeld voor acetylcholine. Hierdoor ontstaat onder andere de typische tremor (tremor) bij de patiënt. Het kan worden verlicht met anticholinergica omdat ze de effecten van acetylcholine in de hersenen blokkeren.
Bijwerkingen: Anticholinergica kunnen een breed scala aan bijwerkingen hebben. Deze omvatten bijvoorbeeld droge mond, droge ogen, verminderd (zelden toegenomen) zweten, blaasledigingsstoornissen, constipatie, snelle hartslag, lichtgevoelige ogen, denkstoornissen en verwardheid.
Vooral oudere mensen verdragen anticholinergica vaak niet goed. Daarom hebben de medicijnen de voorkeur aan jongere patiënten.
NMDA-antagonisten
Net als acetylcholine is de neurotransmitter glutamaat ook bij de ziekte van Parkinson relatief in overmaat beschikbaar door het ontbreken van dopamine. Zogenaamde NMDA-antagonisten (amantadine, budipine) helpen hiertegen. Ze blokkeren bepaalde aanlegplaatsen voor glutamaat in de hersenen en verminderen zo de werking ervan.
NMDA-antagonisten worden gebruikt in de vroege stadia van de primaire ziekte van Parkinson.
Bijwerkingen: Mogelijke bijwerkingen van amantadine zijn bijvoorbeeld rusteloosheid, misselijkheid, verlies van eetlust, droge mond, reticulaire huidveranderingen (livedo reticularis) evenals verwardheid en psychose (vooral bij oudere patiënten). Budipin kan gevaarlijke hartritmestoornissen veroorzaken.
Diepe hersenstimulatie (DBS)
Diepe hersenstimulatie (DBS) is een chirurgische ingreep die op de hersenen wordt uitgevoerd. Het wordt soms gedaan voor de idiopathische ziekte van Parkinson. De Engelse naam is "Deep Brain Stimulation" (DBS).
Bij diepe hersenstimulatie worden tijdens een operatie kleine elektroden in bepaalde hersengebieden ingebracht. Ze zouden de pathologische activiteit van de zenuwcellen positief beïnvloeden (stimuleren of remmen). Dit betekent dat diepe hersenstimulatie op dezelfde manier werkt als een pacemaker. Daarom wordt er soms naar verwezen als een "hersenpacemaker" (zelfs als deze term niet helemaal correct is).
Diepe hersenstimulatie kan worden overwogen als:
- Fluctuaties in het effect (fluctuaties) en onwillekeurige bewegingen (dyskinesie) kunnen niet met medicatie of
- het trillen (tremor) kan niet met medicatie worden verholpen.
Daarnaast moet de patiënt aan andere eisen voldoen. Hij mag bijvoorbeeld geen vroege symptomen van dementie vertonen. Zijn algemene fysieke conditie moet goed zijn. Bovendien moeten de symptomen van Parkinson (behalve de tremor) reageren op L-Dopa.
De ervaring heeft geleerd dat de procedure bij veel patiënten de symptomen effectief kan verlichten en de kwaliteit van leven aanzienlijk kan verbeteren. Het effect lijkt ook op de lange termijn aan te houden. Maar dat betekent niet dat diepe hersenstimulatie de ziekte van Parkinson kan genezen - de ziekte zal na de procedure voortschrijden.
Overigens: Oorspronkelijk werd diepe hersenstimulatie vooral uitgevoerd bij patiënten met de ziekte van Parkinson in een gevorderd stadium. Ondertussen hebben onderzoeken echter aangetoond dat het ook geschikt is voor patiënten onder de 60 jaar, bij wie de behandeling met levodopa pas recentelijk fluctuaties in effectiviteit heeft laten zien en bewegingsstoornissen veroorzaakt.
Hoe werkt de procedure?
Diepe hersenstimulatie wordt uitgevoerd in gespecialiseerde klinieken (DBS-centra). Voor de operatie wordt een stevig metalen frame stevig aan het hoofd van de patiënt bevestigd. Tijdens de eigenlijke operatie is het frame stevig verbonden met de operatietafel. Het hoofd blijft dus altijd in exact dezelfde positie. Dit is nodig om zo precies mogelijk met de medische instrumenten te kunnen werken (“stereotactische hersenchirurgie”).
Een computertomografie (CT) of magnetische resonantietomografie (MRT) scan van de kop die in het frame is geklemd, wordt nu uitgevoerd. Met de computer kan precies worden berekend onder welke hoek en op welke diepte in de hersenen de elektroden moeten worden ingebracht, zodat de elektrodepunten dan op de juiste plaats komen. De "juiste plaats" is meestal een klein gebied in de hersenen dat de subthalamische kern (NST) wordt genoemd.
De volgende stap is de eigenlijke operatie: de neurochirurg boort met een speciale boor twee kleine gaatjes in de bovenkant van de schedel om de kleine elektroden in te brengen. Dat klinkt brutaal, maar het is niet pijnlijk voor de patiënt. Hij is de hele operatie wakker. Dit is nodig zodat de chirurg de juiste plaatsing van de elektroden in een test kan verifiëren.
De volgende dag wordt de pulsgenerator geïmplanteerd onder de huid op het sleutelbeen of op de bovenbuik onder algehele narcose. Het is via kleine kabels verbonden met de elektroden in de hersenen. De kabels lopen onder de huid.
De pulsgenerator levert continu stroom aan de elektroden. Afhankelijk van de frequentie van de stroom worden de gebieden aan de uiteinden van de elektroden gestimuleerd of geremd. Dit verlicht onmiddellijk de belangrijkste motorische symptomen van de ziekte van Parkinson, d.w.z. vertraagde beweging, spierstijfheid en tremoren. Indien nodig kan de netfrequentie worden aangepast met een afstandsbediening.
Als de ingreep niet het gewenste effect heeft, kunnen de elektroden weer worden verwijderd of kan de pulsgenerator worden uitgeschakeld.
Mogelijke complicaties en bijwerkingen
Over het algemeen lijkt diepe hersenstimulatie succesvoller te zijn bij patiënten jonger dan 50 jaar en minder kans op complicaties dan bij oudere mensen.
De belangrijkste complicatie die het gevolg kan zijn van de hersenoperatie zelf is een bloeding in de schedel (intracraniële bloeding). Bovendien kan het inbrengen van de pulsgenerator en kabels een infectie veroorzaken. Dan moet het systeem meestal tijdelijk worden verwijderd en moet de patiënt worden behandeld met antibiotica.
Vrijwel iedere patiënt zal na de ingreep tijdelijke bijwerkingen ervaren als het systeem nog wordt aangepast. Dit kan bijvoorbeeld paresthesie (paresthesie) zijn. Deze treden echter vaak pas direct na het inschakelen van de pulsgenerator op en verdwijnen daarna weer.
Andere meestal tijdelijke effecten zijn bijvoorbeeld verwardheid, verhoogde drive, afgeplatte stemming en apathie. Soms komen ook zogenaamde impulscontrolestoornissen voor. Dit omvat bijvoorbeeld een verhoogd seksueel verlangen (hyperseksualiteit). Bij sommige patiënten veroorzaakt diepe hersenstimulatie ook milde spraakstoornissen, verminderde bewegingscoördinatie (ataxie), duizeligheid en onvaste gang en houding.
Verdere therapiemethoden
Verschillende behandelconcepten kunnen ook Parkinsonpatiënten helpen om hun mobiliteit, spraakvermogen en zelfstandigheid in het dagelijks leven zo lang mogelijk te behouden. De belangrijkste procedures zijn:
Fysiotherapie: Fysiotherapie omvat veel verschillende technieken. De patiënten kunnen bijvoorbeeld tijdens het lopen hun evenwicht en veiligheid trainen met geschikte oefeningen. Ook kracht- en rekoefeningen zijn nuttig. Ook de snelheid en het ritme van de bewegingen kunnen specifiek getraind worden.
Logopedie: Veel patiënten ontwikkelen een spraakstoornis in de loop van de ziekte van Parkinson. U spreekt bijvoorbeeld opvallend eentonig en heel rustig of ervaart herhaaldelijk blokkades bij het spreken. Logopedie kan hierbij helpen.
Ergotherapie: Het doel van ergotherapie is ervoor te zorgen dat Parkinsonpatiënten zo lang mogelijk zelfstandig kunnen blijven in hun persoonlijke omgeving. Hiervoor pas je bijvoorbeeld de leefruimte aan zodat de patiënt beter zijn weg kan vinden. Het verwijdert ook struikelblokken zoals tapijten. De ergotherapeut werkt ook samen met de getroffenen om strategieën te ontwikkelen om beter om te gaan met het dagelijks leven met de ziekte. Hij laat de patiënt bijvoorbeeld zien hoe hulpmiddelen zoals kousentrekkers of knoophulpmiddelen moeten worden gebruikt. Daarnaast adviseert de therapeut de naasten hoe zij de parkinsonpatiënt op een zinvolle manier kunnen ondersteunen in het dagelijks leven.
Behandeling van comorbiditeiten
De ziekte van Parkinson treft vaak ouderen. Deze lijden meestal ook aan andere ziekten zoals hoge bloeddruk, hartfalen (hartfalen), hoge bloedlipidenwaarden of diabetes. Ook deze comorbiditeiten moeten goed worden behandeld. Dit heeft een positief effect op de kwaliteit van leven en de levensverwachting van de patiënt.
Parkinson-therapie: wat kunt u zelf doen?
Zoals bij de meeste chronische klachten en ziekten geldt ook voor Parkinson: getroffenen moeten actief met hun ziekte omgaan en zich informeren over de oorzaken en behandelingsmogelijkheden. Want in veel gevallen is het vooral de angst voor onzekerheid die de patiënt stress geeft. Hoe meer men over de ziekte te weten komt, hoe eerder het gevoel van machteloosheid tegen de voortschrijdende Parkinson verdwijnt.
Helaas is de ziekte momenteel niet te genezen. Met de juiste behandeling kunnen veel patiënten echter een grotendeels normaal leven leiden.
Lees hier wat u kunt bijdragen aan een effectieve therapie:
“Wees open over je ziekte. Veel mensen met Parkinson vinden het in het begin erg moeilijk om de ziekte te accepteren en er openlijk mee om te gaan. In plaats daarvan proberen ze de symptomen te verbergen. Maar dit zet je onnodig onder druk. Openlijk praten over uw toestand met vrienden, familie en collega's zal een enorme last van uw schouders nemen.
“Ontdek de ziekte. Hoe meer u weet over Parkinson, hoe minder eng het voor u lijkt. Als familielid van een parkinsonpatiënt moet u ook meer te weten komen over de ziekte. Zo kunt u uw naasten effectief en verstandig ondersteunen.
»Word lid van een ondersteuningsgroep voor Parkinson. Degenen die regelmatig van gedachten kunnen wisselen met andere patiënten, kunnen de ziekte vaak beter aan.
"Blijf Fit. U kunt een goede algemene conditie behouden en u blijft lichamelijk actief. Regelmatige lichaamsbeweging (zoals wandelen) en lichte duursporten zijn voldoende. De nabestaanden kunnen de patiënt hierin ondersteunen.
»Gebruik kleine hulpmiddelen in het dagelijks leven. Veel symptomen van Parkinson maken het dagelijks leven moeilijk. Hieronder valt ook wat bekend staat als "bevriezen" - de betrokkene kan zich niet meer bewegen. Visuele prikkels op de vloer, bijvoorbeeld opgeplakte voetafdrukken, of akoestische ritmegeneratoren ("Links, twee, drie, vier") helpen hierbij. Belangrijk voor medemensen: Het heeft geen zin de patiënt te haasten of te trekken. Dit heeft de neiging om de "freeze" episode te verlengen.
" Eet gezond. Mensen met de ziekte van Parkinson eten en drinken vaak te weinig omdat ze onhandig en traag zijn. Sommigen willen ook zo veel mogelijk uitputtend naar het toilet gaan. Voor een gezonde algemene conditie is het echter erg belangrijk dat u voldoende drinkt (ongeveer twee liter per dag) en een evenwichtige voeding eet.
Parkinson: gespecialiseerde klinieken
Indien mogelijk moeten mensen met het syndroom van Parkinson worden behandeld in een gespecialiseerde kliniek. Artsen en andere medewerkers daar zijn gespecialiseerd in de ziekte.
Inmiddels zijn er in Duitsland talloze klinieken die acute behandeling en/of revalidatie bieden aan Parkinsonpatiënten. Sommigen van hen hebben een certificaat van de Duitse Parkinson Vereniging (dPV). Het wordt toegekend aan ziekenhuizen en revalidatiecentra die speciale diagnostische en therapeutische aanbiedingen hebben voor mensen met Parkinson en aanverwante ziekten. De speciale klinieken krijgen het certificaat van de dPV voor een periode van drie jaar. Op verzoek van de betreffende instelling kan deze na een hernieuwd examen met nog eens drie jaar worden verlengd.
Een geselecteerde lijst van speciale klinieken voor Parkinsonpatiënten vindt u in het artikel Parkinson - Kliniek.
Parkinson: onderzoeken en diagnose
Als u vermoedt dat u of een familielid de ziekte van Parkinson heeft, is het raadzaam om een gekwalificeerde arts te raadplegen. De specialist in ziekten van het zenuwstelsel is de neuroloog. U kunt het beste naar een neuroloog gaan die gespecialiseerd is in het diagnosticeren en behandelen van de ziekte van Parkinson. Sommige neurologische klinieken hebben ook een eigen spreekuur of polikliniek voor Parkinsonpatiënten.
Arts-patiënt gesprek
Tijdens het eerste bezoek zal de neuroloog een anamnese afnemen (anamnese) in gesprek met u of het betreffende familielid. Dit gesprek is van groot belang voor de diagnose Parkinson: als de patiënt zijn symptomen gedetailleerd beschrijft, kan de arts beoordelen of het daadwerkelijk Parkinson kan zijn. Mogelijke vragen van de arts zijn bijvoorbeeld:
- Sinds wanneer bestaat de tremor (tremor) van de handen/benen ongeveer?
- Heb je het gevoel dat je spieren constant gespannen zijn?
- Heeft u pijn, bijvoorbeeld in de schouder of nek?
- Vind je het moeilijk om je evenwicht te bewaren tijdens het lopen?
- Vindt u fijne motoriek (bijvoorbeeld een overhemd dichtknopen, schrijven) steeds moeilijker?
- Heb je moeite met slapen?
- Merk je dat je reukvermogen achteruit is gegaan?
- Is bij familieleden de ziekte van Parkinson vastgesteld?
- Gebruikt u medicijnen, bijvoorbeeld vanwege psychische problemen? (Antipsychotica, "dopamine-antagonisten" zoals metoclopramide)
Lichamelijk en neurologisch onderzoek
Naast het anamnesegesprek volgt een lichamelijk en een neurologisch onderzoek. De arts controleert over het algemeen de functie van het zenuwstelsel: hij test bijvoorbeeld de reflexen van de patiënt, de gevoeligheid van de huid en de beweeglijkheid van de spieren en gewrichten. Hij besteedt speciale aandacht aan de belangrijkste symptomen van Parkinson:
Vertraagde bewegingen (bradykinesie) zijn zeer kenmerkend voor Parkinson. De arts zal u herkennen door uw gang, gebaren en gezichtsuitdrukkingen te observeren. Hij kan u vragen enkele meters te lopen in de onderzoekskamer. Hij kan ook beoordelen of u “wankel op uw voeten” staat (houdingsinstabiliteit).
Om te bepalen of uw spieren merkbaar stijf zijn (stijfheid), controleert de arts of uw gewrichten soepel kunnen worden bewogen. Bij de ziekte van Parkinson neemt de spierspanning sterk toe, waardoor de spieren weerstand bieden wanneer de arts een gewricht (zoals de elleboog) probeert te bewegen. Dit fenomeen wordt ook wel het tandwielfenomeen genoemd (zie hierboven: "Parkinson: Symptomen").
Tijdens het lichamelijk onderzoek zal de arts vaststellen of u in rust tremor heeft (rusttremor). Bij het diagnosticeren van de ziekte van Parkinson is het belangrijk onderscheid te maken tussen rusttremoren (zoals die voorkomt bij de ziekte van Parkinson) en andere vormen van tremor. Dit omvat bijvoorbeeld de zogenaamde intentietremor: als het cerebellum beschadigd is, begint de hand te trillen zodra de persoon in kwestie er een specifieke beweging mee probeert uit te voeren. Aan de andere kant trilt de hand niet in rust.
Parkinson-test (L-dopa-test)
Om de diagnose van Parkinson te helpen stellen, wordt soms de zogenaamde L-dopa-test gedaan. Patiënten krijgen eenmaal de dopamineprecursor L-Dopa (levodopa). Dit is het medicijn dat standaardtherapie is voor de ziekte van Parkinson. Bij sommige patiënten verbeteren bewegingsstoornissen en stijve spieren kort na inname (ongeveer een half uur daarna). Dan is er waarschijnlijk sprake van een idiopathisch syndroom van Parkinson (let op: de rusttremor kan niet altijd worden verlicht met levodopa).
De L-Dopa-test is slechts beperkt bruikbaar bij de diagnose van Parkinson. Omdat sommige mensen Parkinson hebben, maar niet reageren op de test. Dan is het resultaat vals-negatief. Omgekeerd kan de L-Dopa-test ook positief zijn voor andere ziekten dan Parkinson. Dit geldt bijvoorbeeld voor sommige (maar niet alle) patiënten met zogenaamde multisysteematrofie. Bij deze progressieve ziekte sterven zenuwcellen in verschillende delen van de hersenen. Dit kan een atypisch Parkinson-syndroom veroorzaken.
Vanwege deze problemen wordt de L-dopa-test niet routinematig aanbevolen bij de diagnose van Parkinson. Een andere reden hiervoor is dat het bijwerkingen kan hebben zoals misselijkheid en braken. Om dit te voorkomen, krijgen patiënten meestal het anti-emeticum domperidon vóór de test.
De L-Dopa-test kan ook helpen bij het plannen van de therapie voor de ziekte van Parkinson: als de ziekte van Parkinson wordt vastgesteld, kan de test worden gebruikt om te controleren hoe goed de patiënt op L-Dopa reageert. Maar ook hier mag men geen duidelijk testresultaat verwachten. Sommige patiënten reageren niet op de test (negatieve uitslag), maar kunnen later toch goed met levodopa worden behandeld.
Trouwens: in plaats van de L-Dopa-test wordt af en toe de apomorfinetest gedaan om de ziekte van Parkinson te diagnosticeren. Hier wordt gecontroleerd of de bewegingsstoornissen verbeteren na een apomorfine-injectie. Als dat zo is, spreekt dit voor idiopathisch parkinonsyndroom. Hier geldt hetzelfde als bij de L-Dopa-test: de test is niet bij elke Parkinsonpatiënt positief. Daarnaast kunnen bijwerkingen zoals misselijkheid, braken of slaperigheid optreden.
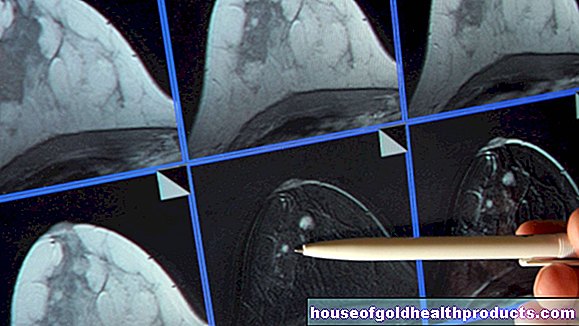
Beeldvormingsprocedures
Met behulp van computertomografie (CT) of magnetische resonantiebeeldvorming (MRT) kunnen de hersenen van de patiënt worden gevisualiseerd. Dit kan helpen bij het uitsluiten van andere mogelijke oorzaken van de vermoedelijke symptomen van Parkinson, zoals een hersentumor. Hersenbeeldvorming helpt dus om de idiopathische ziekte van Parkinson te onderscheiden van secundaire Parkinson of andere neurodegeneratieve ziekten (zoals atypische Parkinson).
Hiervoor kunnen ook speciale onderzoeken worden uitgevoerd. Denk hierbij aan SPECT (Single Photon Emission Computed Tomography), een nucleair geneeskundig onderzoek: de patiënt krijgt eerst een radioactieve stof toegediend. Dit kan worden gebruikt om die zenuwuiteinden in de hersenen weer te geven die achteruitgaan bij de ziekte van Parkinson (DAT-SPECT). Dit kan informatie opleveren in onduidelijke gevallen.
Als de diagnose van Parkinson onduidelijk is, bestelt de arts soms een speciale variant van positronemissietomografie (PET): FDG-PET. De afkorting FDG staat voor fluorodeoxyglucose. Dit is een radioactief gelabelde enkelvoudige suiker. Het wordt aan de patiënt gegeven voordat de hersenen worden afgebeeld met PET. Bovenal kan dit onderzoek helpen om een atypisch Parkinson-syndroom op te helderen. Het onderzoek is hiervoor echter niet officieel goedgekeurd. Het wordt daarom alleen gebruikt in gerechtvaardigde individuele gevallen ("off-label gebruik").
Het echografisch onderzoek van de hersenen (transcraniële echografie, TCS) is minder complex en goedkoper dan deze speciale onderzoeken. Het helpt om het idiopathische syndroom van Parkinson in een vroeg stadium te herkennen en het te onderscheiden van andere ziekten (zoals atypische Parkinson-syndromen). De arts moet echter uitgebreide ervaring hebben met dit onderzoek. Anders kan hij het testresultaat mogelijk niet correct interpreteren.
Hoe wordt de diagnose Parkinson uiteindelijk gesteld?
Het is nog vaak moeilijk om een eenduidige diagnose van Parkinson te stellen. Een reden hiervoor is dat er veel verschillende aandoeningen zijn die symptomen veroorzaken die lijken op de ziekte van Parkinson.
Het arts-patiëntgesprek (anamnese) en het lichamelijk-neurologisch onderzoek zijn essentieel voor de diagnose van Parkinson. Het primaire doel van verder onderzoek is om andere redenen voor de symptomen uit te sluiten. De ziekte van Parkinson (idiopathisch Parkinson-syndroom) kan alleen worden gediagnosticeerd als de symptomen kunnen worden verklaard door de ziekte van Parkinson en er geen andere oorzaken kunnen worden gevonden.
Speciaal geval: Genetisch bepaalde Parkinson
Zoals vermeld in de sectie "Oorzaken", zijn genetische vormen van Parkinson zeer zeldzaam. Ze kunnen echter worden bepaald met een moleculair genetisch onderzoek. Een dergelijk onderzoek kan worden overwogen indien:
- de patiënt krijgt Parkinson voor de leeftijd van 45 jaar of
- tenminste twee eerstegraads familieleden hebben de ziekte van Parkinson.
In deze gevallen wordt vermoed dat de ziekte van Parkinson wordt veroorzaakt door een genmutatie.
Gezonde familieleden van een patiënt met de genetische ziekte van Parkinson kunnen ook een genetische test ondergaan. Op deze manier kan worden vastgesteld of ze ook de triggerende genmutatie hebben. Een dergelijke genetische test ter beoordeling van het persoonlijk Parkinson-risico mag pas worden uitgevoerd nadat de betrokkene uitvoerig genetisch advies heeft gekregen van een specialist.
Verloop van de ziekte en prognose
Het idiopathische syndroom van Parkinson is een progressieve ziekte die nog niet is genezen. Afhankelijk van de symptomen maken artsen onderscheid tussen vier soorten cursussen:
- Akinetisch-rigide type: Er zijn voornamelijk immobiliteit en spierstijfheid, terwijl tremor niet of nauwelijks is.
- Tremor Dominantie Type: Het belangrijkste symptoom is tremor (tremor).
- Equivalentietype: immobiliteit, spierstijfheid en tremoren zijn ongeveer hetzelfde.
- Monosymptomatische tremor in rust: de tremor in rust is het enige symptoom. Zeer zeldzame vorm.
Naast de beloopvorm speelt de aanvangsleeftijd bij Parkinson een belangrijke rol: beloop en prognose worden beïnvloed door of de ziekte op relatief jonge leeftijd (bijvoorbeeld vanaf 40 jaar) of op oudere leeftijd uitbreekt.
Bij jongere patiënten is het veel waarschijnlijker dat de medicatie van Parkinson bewegingsstoornissen (dyskinesie) en fluctuaties in effect veroorzaakt. Dit geldt in het bijzonder voor het akinetisch-rigide type Parkinson, voor wie een vroeg begin van de ziekte typisch is. In plaats daarvan werkt levodopa goed bij deze patiënten.
Het is anders met het type tremordominantie: de getroffenen reageren relatief slecht op L-dopa. Aan de andere kant verloopt de ziekte van Parkinson bij hen langzamer dan bij de andere vormen van ziekte. Het tremordominaz-type heeft dus de gunstigste prognose.
Parkinson: levensverwachting
Halverwege de jaren zeventig werden moderne Parkinson-medicijnen zoals levodopa ontwikkeld. Dat veranderde de prognose voor "echte" (idiopathische) Parkinson: levensverwachting en kwaliteit van leven van de patiënten verbeterden dankzij de nieuwe actieve ingrediënten. Volgens statistieken heeft een optimaal behandelde Parkinson-patiënt vandaag bijna dezelfde levensverwachting als een gezonde persoon van dezelfde leeftijd: als iemand vandaag op 63-jarige leeftijd de diagnose Parkinson krijgt, kunnen ze nog steeds een geschatte 20 jaar van leven verwachten. Ter vergelijking: in het midden van de vorige eeuw leefden patiënten gemiddeld iets meer dan negen jaar na diagnose.
De verhoogde levensverwachting bij het idiopathische syndroom van Parkinson is te wijten aan het feit dat moderne medicijnen de belangrijkste klachten van de patiënten grotendeels verhelpen. In het verleden leidden dergelijke klachten vaak tot complicaties waardoor de patiënt vroegtijdig overleed. Een voorbeeld: Parkinsonpatiënten die nauwelijks konden bewegen (akinesie) waren vaak bedlegerig. Deze bedrust verhoogt enorm het risico op gevaarlijke ziekten zoals trombose of longontsteking.
De verbeterde levensverwachting, zoals die hier wordt beschreven, heeft alleen betrekking op het idiopathische Parkinson-syndroom (= de "klassieke Parkinson"). Atypische Parkinson-syndromen, waarbij de getroffenen niet of nauwelijks reageren op behandeling met L-Dopa, vorderen gewoonlijk sneller. Ze hebben meestal een veel slechtere prognose.
Extra informatie
Boek aanbevelingen:
- Parkinson - het werkboek: actief blijven met bewegingsoefeningen (Elmar Trutt, 2017, TRIAS)
- Parkinson: een gids voor getroffenen en hun familieleden (Willibald Gerschlager, 2017, Facultas / Maudrich)
Richtlijnen:
- S3-richtlijn "Idiopathisch Parkinson-syndroom" van de Duitse Vereniging voor Neurologie (vanaf 2016)
Zelfhulpgroepen:
Duitse Parkinson Vereniging e.V.:
https://www.parkinson-vereinigung.de