Off-label gebruik
Martina Feichter studeerde biologie met een keuzevak farmacie in Innsbruck en verdiepte zich ook in de wereld van geneeskrachtige planten. Van daaruit was het niet ver meer naar andere medische onderwerpen die haar tot op de dag van vandaag boeien. Ze volgde een opleiding tot journalist aan de Axel Springer Academy in Hamburg en werkt sinds 2007 voor - eerst als redacteur en sinds 2012 als freelance schrijver.
Meer over de experts Alle inhoud van wordt gecontroleerd door medische journalisten.
Bij off-label gebruik worden geneesmiddelen gebruikt buiten hun officiële goedkeuring om. Als de arts bijvoorbeeld aan een kind een antibioticum voorschrijft dat alleen voor volwassenen is goedgekeurd, gebeurt dit "off label". Hier leest u welke redenen er kunnen zijn voor off-label gebruik en welke risico's daaraan verbonden zijn!

Wat betekent "off-label gebruik"?
De Engelse term "off-label use" betekent "improper use" of "non-approved use". Dit betekent het gebruik van een medicijn tegen kwalen of ziekten of bij bepaalde patiëntengroepen voor wiens behandeling het betreffende medicijn eigenlijk geen goedkeuring heeft van de regelgevende instanties.
De toegang is strikt gereguleerd
Een dergelijke goedkeuring, d.w.z. goedkeuring, is vereist voor elk medicijn: als een farmaceutisch bedrijf een nieuw medicijn heeft ontwikkeld, moet dit nog worden goedgekeurd door de autoriteiten, dat wil zeggen gecontroleerd en goedgekeurd. De bevoegde vergunningverlenende autoriteit voor de meeste geneesmiddelen in Duitsland is het Federale Instituut voor Geneesmiddelen en Medische Hulpmiddelen (BfArM). Voor sommige medicijnen (zoals vaccins) moet het Paul Ehrlich Instituut (PEI) echter goedkeuring verlenen.
Een dergelijke goedkeuring is alleen geldig voor een specifiek toepassingsgebied - voor een specifieke ziekte of een specifiek symptoom en een specifieke groep mensen (bijvoorbeeld acute migraine met of zonder aura bij volwassenen). Ook de soort toepassing van het geneesmiddel (bijvoorbeeld als tablet of injectiespuit onder de huid), de dosering en de gebruiksduur worden in de goedkeuring vermeld.
Een fabrikant kan van meet af aan meerdere goedkeuringen aanvragen voor zijn geneesmiddel, dus voor meerdere toepassingsgebieden. Of hij kan een verlenging van een bestaande goedkeuring aanvragen, zodat bijvoorbeeld een griepmedicijn voor volwassenen in de toekomst ook voor kinderen wordt goedgekeurd.
Voor elk aangevraagd toepassingsgebied moet het farmaceutisch bedrijf onderzoeksresultaten overleggen aan de regelgevende instanties die het effectieve en veilige gebruik van het geneesmiddel in dit toepassingsgebied en in deze vorm aantonen.
Off-label gebruik onder bepaalde voorwaarden
In de praktijk blijken sommige medicijnen echter ook nuttig te zijn bij andere aandoeningen, ziekten of groepen mensen dan is toegestaan. De fabrikant zou dan ook voor deze toepassingsgebieden goedkeuring kunnen aanvragen. Omdat dit echter erg kostbaar en tijdrovend is, doen farmaceutische bedrijven het vaak zonder.
Het komt dus voor dat artsen onder bepaalde voorwaarden veel medicijnen gebruiken buiten hun goedkeuring ("off label"). Artsen gebruiken dit off-label gebruik bijvoorbeeld wanneer een ziekte niet adequaat kan worden behandeld met de voor hen goedgekeurde medicijnen, maar een medicijn dat niet is goedgekeurd, is hier effectief gebleken.
Off-label gebruik: de juridische situatie
Elke arts mag in principe geneesmiddelen voorschrijven buiten de respectieve goedkeuring om. Hij zou dit zelfs moeten doen als, vanuit zijn professionele oogpunt, het betreffende preparaat de beste behandelingsoptie is voor een bepaalde patiënt. Voor de zekerheid raden medische verenigingen echter alleen off-label gebruik aan medische professionals aan als wetenschappelijke onderzoeken hebben aangetoond dat het medicijn ook effectief is in het niet-goedgekeurde toepassingsgebied.
Als de arts een medicijn "off label" wil voorschrijven, is hij verplicht de patiënt zorgvuldig te informeren: hij moet erop wijzen dat het betreffende medicijn niet is goedgekeurd voor het beoogde gebruik. De arts moet de patiënt ook informeren over mogelijke alternatieven, het verloop van de geplande behandeling en mogelijke gevolgen en risico's.
Aansprakelijkheid voor bijwerkingen
Als artsen een geneesmiddel voorschrijven zoals bedoeld (d.w.z. in de aanbevolen dosering) binnen de reikwijdte van de goedkeuring en de patiënt krijgt dan ernstige bijwerkingen, dan is de fabrikant hiervoor aansprakelijk.
Bij off-label gebruik is de situatie anders: als de arts een geneesmiddel voorschrijft buiten de goedkeuring om, kan hij aansprakelijk worden gesteld voor ernstige bijwerkingen. Het farmaceutisch bedrijf draagt hier in de regel geen aansprakelijkheid.
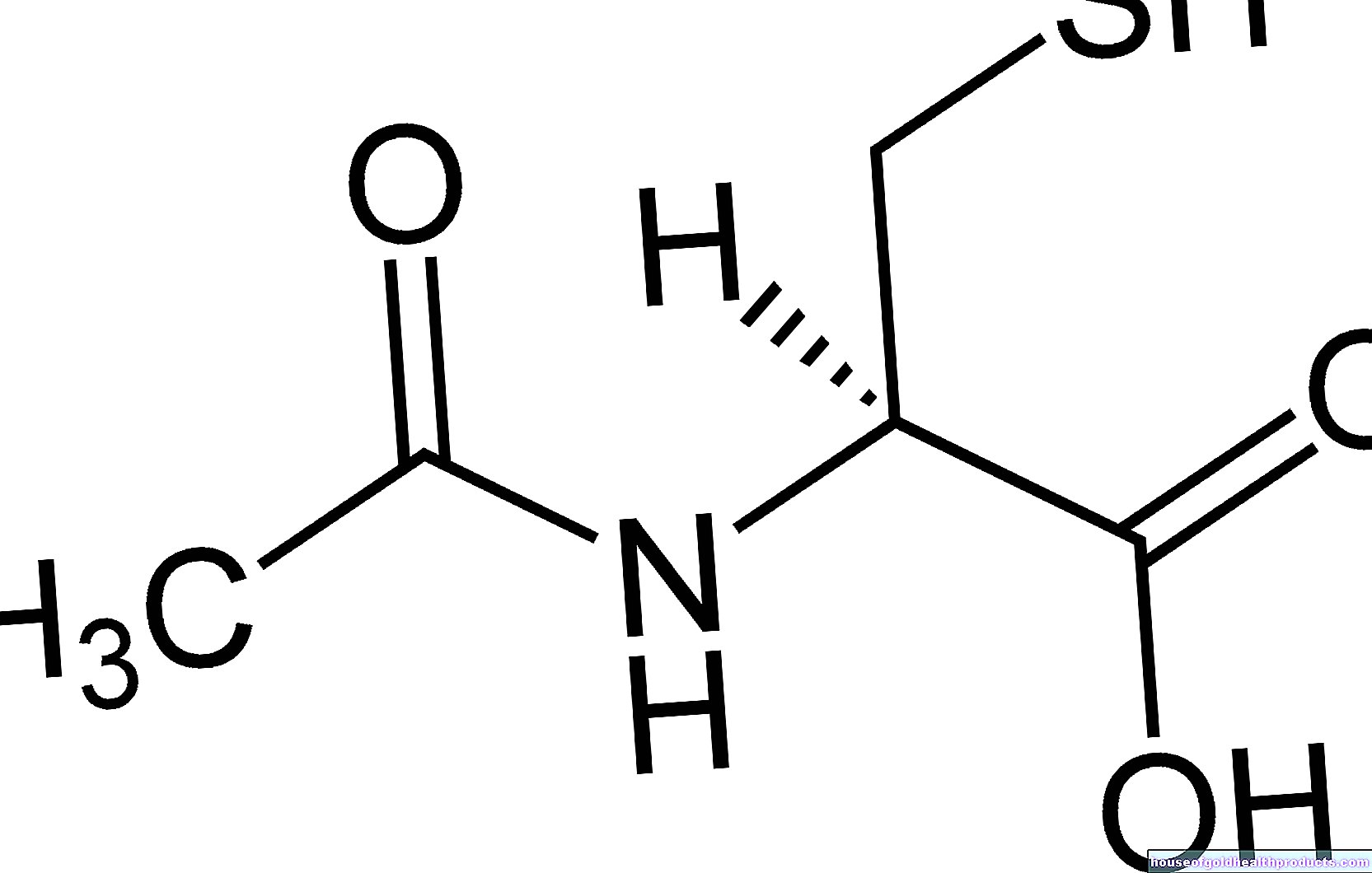
Er zijn echter uitzonderingen: sommige fabrikanten van geneesmiddelen die valproïnezuur bevatten, hebben bijvoorbeeld het off-label gebruik van hun preparaat voor de preventie van migraine erkend - en hebben dus ook de aansprakelijkheid voor dergelijk gebruik op zich genomen.
Off-label gebruik: risico's
De werkzaamheid van een geneesmiddel buiten de goedgekeurde toepassingsgebieden is veelal niet wetenschappelijk onderzocht en tot in detail bewezen. Ook ontbreken vaak betrouwbare wetenschappelijke gegevens over de mogelijke bijwerkingen en risico's, vooral met betrekking tot off-label gebruik (algemene gegevens over bijwerkingen van een geneesmiddel komen echter meestal voort uit de onderzoeken van de eerste goedkeuringen).
De juiste dosering is ook niet altijd gemakkelijk in te schatten bij off-label gebruik, bijvoorbeeld wanneer kinderen behandeld moeten worden met een geneesmiddel voor volwassenen. Omdat de dosis en het effect van een medicijn niet noodzakelijk evenredig zijn met de lichaamsafmetingen (lengte, gewicht, lichaamsoppervlak). Het simpelweg halveren van de dosis voor een volwassene van 70 kg bij de behandeling van een kind van 35 kg kan verkeerd zijn - de verlaagde dosis is mogelijk niet effectief genoeg of nog steeds te hoog voor het kind.
Als het gaat om off-label gebruik, oriënteren artsen zich meestal op onderzoeken die het gebruik van een medicijn in een niet-goedgekeurd gebied onderzoeken. Dit onderzoek is vaak van goede kwaliteit en bevat informatie zoals dosering en gebruiksduur. In dergelijke gevallen wordt off-label gebruik minder een probleem. Ze zijn echter niet voldoende om officiële goedkeuring van het medicijn voor het toepassingsgebied te verkrijgen.
Off-label gebruik: voorbeelden
Er zijn een aantal actieve ingrediënten die artsen off-label gebruiken. Hieronder worden enkele voorbeelden gegeven.
Geneesmiddelen voor volwassenen voor kinderen
Sommige geneesmiddelen op de markt zijn alleen getest op werkzaamheid en veiligheid bij volwassenen en zijn alleen goedgekeurd voor gebruik bij volwassenen. De onderzoeken bij volwassenen die nodig zijn voor goedkeuring zijn voor farmaceutische bedrijven minder tijdrovend dan overeenkomstige onderzoeken bij kinderen.
Dit betekent dat artsen bij de behandeling van kinderen mogelijk hun toevlucht moeten nemen tot "medicatie voor volwassenen", omdat er geen overeenkomstige goedgekeurde preparaten voor kinderen zijn.
Een EU-verordening die sinds 2007 van kracht is, biedt onder meer farmaceutische fabrikanten speciale prikkels om geneesmiddelen voor kinderen op de markt te brengen, d.w.z. preparaten waarvan het effectieve en veilige gebruik bij kinderen voldoende is getest en vervolgens is goedgekeurd.
Tegelijkertijd zorgt de verordening ervoor dat de medicijnen van hoge kwaliteit worden onderzocht en dat ze goed worden goedgekeurd.
Epilepsiemedicatie voor migraine
Het medicijn valproïnezuur heeft een krampstillend effect en is goedgekeurd voor de behandeling van epilepsie en bipolaire stoornissen. Volgens studies kan het ook migraine voorkomen, d.w.z. het aantal migraineaanvallen bij volwassen patiënten effectief verminderen.
Daarom wordt het werkzame bestanddeel onder bepaalde omstandigheden off-label gebruikt voor de profylaxe van migraine bij volwassenen. Een van de voorwaarden is dat goedgekeurde migraineprofylaxemiddelen niet hebben gewerkt of niet voor de patiënt mogen worden gebruikt.
Bij kinderen en adolescenten kan valproïnezuur migraine niet beter voorkomen dan een schijngeneesmiddel (placebo). Daarom is het actieve ingrediënt niet geschikt voor migraineprofylaxe bij deze groep patiënten.
Kankermedicijnen "off label"
Het duurt lang voordat het complexe goedkeuringsproces voor een medicijn is afgerond - tijd die bij de behandeling van kankerpatiënten vaak niet beschikbaar is. Daarom is off-label gebruik bij kankertherapie niet ongewoon:
In veel gevallen zijn de gepresenteerde onderzoeken naar de werkzaamheid en veiligheid van een geneesmiddel al gecontroleerd door de goedkeuringsinstantie en zijn de positieve resultaten van deze test al gepubliceerd, maar is het goedkeuringsproces nog niet volledig afgerond. Tot die tijd wordt het middel vaak standaard gebruikt bij kankertherapie en zelfs aanbevolen in medische richtlijnen.
Een andere mogelijkheid: een medicijn dat is goedgekeurd voor de behandeling van bijvoorbeeld longkanker, is ook effectief gebleken bij maagkanker. De fabrikant kan dan verlenging van de goedkeuring aanvragen, wat weer tijdrovend is. In de tussentijd (d.w.z. tijdelijk) kunnen artsen het longkankermedicijn dan off-label gebruiken tegen kwaadaardige maagtumoren.
Soms besparen fabrikanten zichzelf een tijdrovende en kostbare verdere goedkeuring. Dan kan het zijn dat het off-label gebruik praktisch permanent is.
"Off-label" medicijnen: betaalt de zorgverzekeraar?
Patiënten moeten de "off-label" therapie meestal uit eigen zak betalen. De wettelijke zorgverzekeraars vergoeden de kosten alleen onder bepaalde voorwaarden.
Voorwaarde hiervoor is dat experts het off-label gebruik positief beoordelen. Om dit te doen, controleren ze wetenschappelijke gegevens over de effectiviteit van het medicijn in het niet-goedgekeurde toepassingsgebied. Ze houden ook rekening met de vraag of de ziekte ernstig is, welke andere therapiemogelijkheden er zijn en wat de kansen op succes van de "off-label" therapie zijn.
Bovendien moet het medicijn in kwestie een soort goedkeuring hebben in Duitsland, wil een zorgverzekeraar de "off-label" toepassing betalen.
Een andere voorwaarde voor het overnemen van kosten is dat de fabrikant van het betreffende medicijn instemt met off-label gebruik - d.w.z. het gebruik van zijn medicijn in het niet-goedgekeurde toepassingsgebied erkent en er dus aansprakelijkheid voor aanvaardt. Dan kunnen de wettelijke zorgverzekeraars besluiten de kosten te dekken.
Dit is bijvoorbeeld mogelijk voor de bovengenoemde geneesmiddelen die valproïnezuur bevatten, waarvoor de fabrikanten het off-label gebruik voor migraineprofylaxe hebben goedgekeurd.
Tags: anatomie onvervulde kinderwens E.H.B.O